(一)
这两天,我的朋友圈被T-DXd这个药刷屏了。
在纽约的Modi教授分享了抗癌新药T-DXd(全称是Trastuzumab Deruxtecan,以前叫DS-8201)针对“HER2低表达”乳腺癌的3期临床研究结果后,听众(主要是医生和制药圈人士)主动站起来长时间鼓掌,甚至发出欢呼,这种反应在专业会议上是极为少见的。上一次大家这么激动,好像还是10年前免疫O药和K药横空出世的时候。
大家之所以激动,是因为这个研究结果会直接改变乳腺癌的临床分型和治疗标准。同时,它证明了新一代抗体偶联药物的巨大潜力,让大家开始憧憬这一类药物在更多肿瘤类型的突破。
最近是抗癌新药井喷时期,基本每个月都有新药上市。在过去10多年,有超过100个抗癌药获批。每隔一段时间,就会蹦出一个真正“革命性“的药物或治疗方案,让人特别兴奋。
它们的共同特点,是颠覆了以往的肿瘤治疗方案,让不可能成为可能,凭借一己之力,让医生重新对肿瘤进行分类和管理。
2001年,伊马替尼(格列卫)上市,成为全球第一个针对癌症突变基因的靶向药物。携带BCR-ABL融合突变的白血病患者,5年生存率从30%一跃达到90%!
几年后,EGFR靶向药吉非替尼(易瑞沙)和ALK靶向药克唑替尼(赛可瑞)的出现,则开启了肺癌的靶向治疗时代,直接带动了非小细胞肺癌患者,尤其是肺腺癌的常规基因检测。有这些突变的肺癌,和其它肺癌就不一样了。有突变用靶向药,没突变用化疗,成为了新的标准。
2014年,O药和K药相继上市,联手开启了肿瘤免疫治疗时代。它最大的两个特点,一是泛癌种,二是疗效可持续。很多获益的患者实现了长期生存,而PD-L1蛋白表达量、MSI-H微卫星不稳定、肿瘤突变负荷等新的免疫肿瘤标记物也开始为患者和医生熟知。
CD19-CAR-T疗法的出现,则开启了肿瘤新型细胞治疗时代,改变了很多血液肿瘤患者的命运。它证明了人工改造免疫细胞来对抗癌症是可行的,首次尝试的儿童白血病患者Emily已经康复10年了,成为了世界级的网红。更多的靶点(比如BCMA或Claudin 18.2),更多的细胞治疗形式(比如TCR-T或者CAR-NK)在临床研究中已经被验证,或者正在被验证,突破层出不穷。
现在,T-DXd的出现,也将开启一个新时代,那就是“HER2低表达”乳腺癌的精准治疗时代。
这类患者很多,占了整个乳腺癌患者的50%左右,但以前在临床上并不单独区分。T-DXd的出现,让这些患者成为了一个新的精准治疗群体。
(二)
HER2是一个对很多肿瘤细胞,包括一部分乳腺癌细胞生长很重要的蛋白。以往,根据肿瘤的HER2蛋白表达量,乳腺癌患者被简单分为“HER2阳性”和“HER2阴性”两大类,其中阳性患者占了约20%,阴性占了约80%。
由于HER2阳性患者的肿瘤生长依赖这个信号通路,所以科学家开发了针对HER2的多款靶向药,比如曲妥珠单抗、帕妥珠单抗、恩美曲妥珠单抗、吡咯替尼、拉帕替尼等,它们对HER2阳性患者整体有效,但对HER2阴性的患者效果不佳。
在这80%的所谓HER2阴性乳腺癌患者里面,其实还可以再细分为两类,其中约25%是真的完全没有HER2蛋白的,属于真的“阴性”,而更多是表达一些HER2蛋白的,只是表达量不是特别高。准确地说,它们是“HER2低表达”乳腺癌。
乳腺癌患者看自己的病理报告,会发现HER2这个指标边上有个数字,分为了4档,分别是0、1+、2+或者3+。数字越大,表示肿瘤HER2蛋白表达量越高。 HER2表达特别高的乳腺癌(3+和部分2+),才被称为阳性,而0、1+和剩下的2+,都被归为阴性。但其实1+和2+,意味着肿瘤细胞是有HER2表达的,它们和0,也就是完全不表达,还是有区别的。
既然有区别,为什么它们都被统称为HER2阴性呢?这主要是由于对以前HER2靶向药的响应决定的。
肿瘤的分类,通常都和治疗方案密切相关。以往研究发现,“HER2低表达”的乳腺癌患者用了HER2靶向药后,效果并不好,和不表达的患者差不多。所以一直以来,这些“HER2低表达”的乳腺癌,就被归入了“HER2阴性”的行列,治疗的方法也很类似。
简单的说,“HER2低表达”乳腺癌患者,以前并没能从HER2靶向药中获益。 这就像一个人有些稀稀拉拉的头发,,另一个人是光头锃亮,理论上确实有区别,一个是“头发少”,一个是“没头发”,但如果打架薅头发,这俩可能就没区别,都薅不到啥东西!
但现在T-DXd改变了这个结果,研究发现它对“HER2低表达”患者也有效果,突然之间,这些人和“不表达”患者就不一样了。
T-DXd就像是个薅头发的高手,只要头上有毛就会被薅,所以 “头上有几根毛”,和“头上没毛”,就有了本质区别。
这次公布的数据显示,“HER2低表达”的乳腺癌患者使用T-Dxd,治疗效果显著优于目前的标准疗法:化疗。
整体的中位无进展生存期从5.1个月,提高到了9.9个月,而中位总生存期从16.8个月,提高到了23.4个月。
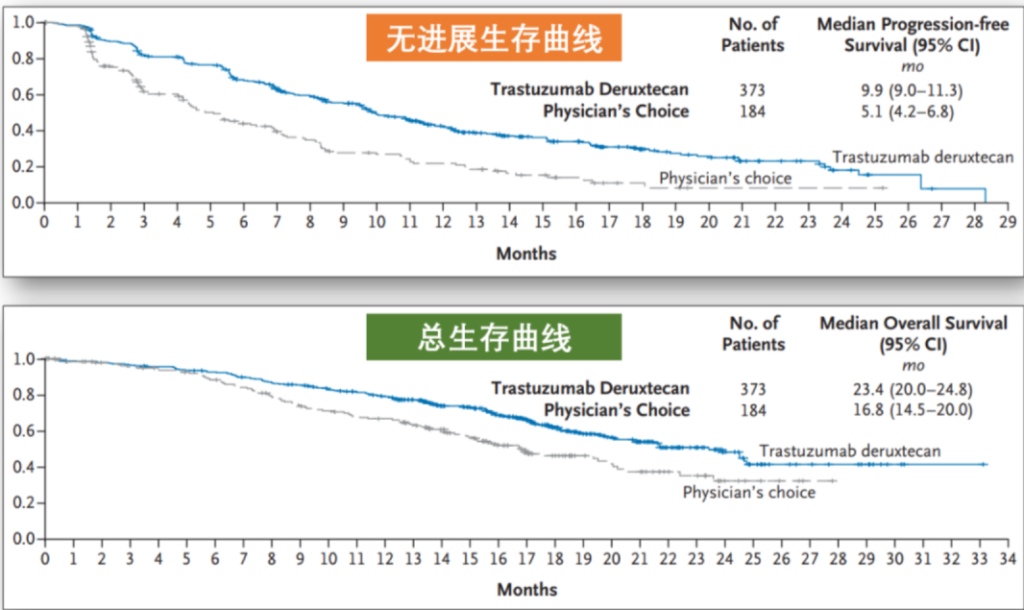
毫无疑问,以后“HER2低表达”乳腺癌将成为一种特殊的亚型,因为有了针对性的有效治疗手段。
随着“HER2低表达”概念的兴起,三阴性乳腺癌将被进一步细分,其中“HER2低表达”的三阴乳腺癌,可以考虑T-DXd这种新型HER2靶向药,而不是和其他患者一样只有化疗这个选择。
而激素受体阳性乳腺癌也会被进一步细分,其中“HER2低表达”的患者,除了常用的内分泌药物、CDK4/6靶向药等,还可以考虑T-DXd。这次研究发现,对内分泌药物或者CDK4/6靶向药耐药的患者,T-DXd依然可能起效。医生手里又多了一个很好的武器。未来这些药物的联用,非常值得期待。
(三)
T-DXd属于一类新型抗癌药,叫“抗体偶联药物(缩写是ADC)”。
这一类药物有两个关键组成部分:能识别肿瘤的抗体,能杀死细胞的毒素。
毒素和抗体绑定在一起,形成了一个导弹系统。抗体是导航系统,毒素是炸药。进入人体后,抗体能特异地识别肿瘤细胞,然后再把毒性释放到肿瘤细胞附近,定向爆破,从而杀死肿瘤细胞。
抗体偶联药物,代表了抗癌药开发的一个重要趋势,那就是“精准投放”。
杀死肿瘤细胞是很容易的,难的是在杀死肿瘤细胞的同时,不杀死正常的细胞。药物进入体内后,如果只是均匀分布,经常肿瘤细胞还没有杀干净,很多正常细胞就不行了,患者就承受不住了。这就是为啥化疗很难根治癌症,因为总有些肿瘤细胞比正常细胞更能扛。
如果有一种办法,能把毒药特异地送到肿瘤那里,让药物局部浓度很高,那就有可能在杀死癌细胞的同时,减少对正常细胞的影响,从而提高药物的效果。这就是开发“抗体偶联药物”的背后逻辑。
T-DXd是一个针对HER2的抗体偶联药物。顾名思义,它使用了针对肿瘤细胞HER2的抗体,来把大量毒素定向投放到肿瘤细胞,实现精准杀伤。
T-DXd不是第一个吃螃蟹的。
乳腺癌中第一个上市的HER2抗体偶联药物叫恩美曲妥珠单抗(缩写是T-DM1),它针对的是HER2阳性乳腺癌患者。现在新一代的T-DXd,把适应人群大大扩展了。
在乳腺癌领域,最近还有针对TROP2靶点的抗体偶联药物Trodelvy获批,用于TROP2阳性的三阴乳腺癌治疗。
T-DXd在乳腺癌中的成功,带给了大家无限的想象力。
首先,抗体偶联药物本质上是一种泛癌肿的治疗药物,只要肿瘤表达这个靶点,就有可能获益(有时需要联合用药)。T-DXd不仅对乳腺癌有效,而且对于HER2阳性的胃癌、肺癌也已经展现了疗效。可以想象,未来越来越多肿瘤,在做病理的时候,都会进行HER2蛋白检测。
类似的,针对Trop2的抗体偶联药物,不仅对三阴乳腺癌有效,在Trop2阳性的肺癌和膀胱癌等也看到了积极效果。
其次,T-DXd用的是个新的抗体偶联药物技术平台。换一个靶点和抗体,就可能产生针对其它癌症类型的新药。比如,同一家公司针对HER3这个蛋白的新药HER3-DXd也获得了美国FDA授予的突破性疗法认定,有望对携带EGFR基因突变,但对靶向药/化疗已经耐药的患者带来全新的方案。
科学的进步总是曲折前进的。在过去很多年,由于技术不成熟,很多抗体偶联药物都失败了,许多公司心灰意冷,砍掉了相关的部门和科研人员。但随着T-DXd的横空出世,让大家又燃起了希望。一夜之间,做抗体偶联药物的公司就成了炙手可热的香饽饽。
但不同的抗体偶联药物技术差别很大,需要到临床验证。到底行不行,还得数据说了算。
祝贺T-DXd研究团队,也致敬所有在肿瘤新药开发路上奋斗的人。好消息总是越来越多,我们距离把更多癌症变成慢性病,也越来越近了。
致敬生命!
参考文献: Trastuzumab Deruxtecan in Previously Treated HER2-Low Advanced Breast Cancer. NEJM June 5, 2022