
2024年11月18日,强生宣布ICONIC-LEAD 的积极顶线结果,这是一项关键的三期临床试验,研究对象为 icotrokinra (JNJ-2113),icotrokinra 是首个选择性阻断 IL-23 受体的靶向口服肽,针对患有中度至重度斑块状银屑病 (PsO) 的成人和 12 岁及以上的青少年。

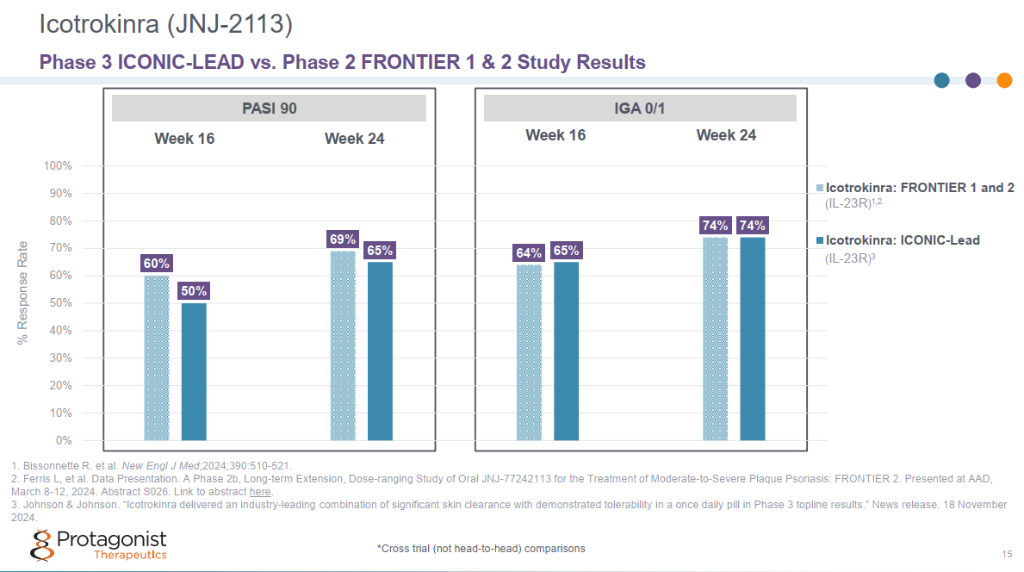
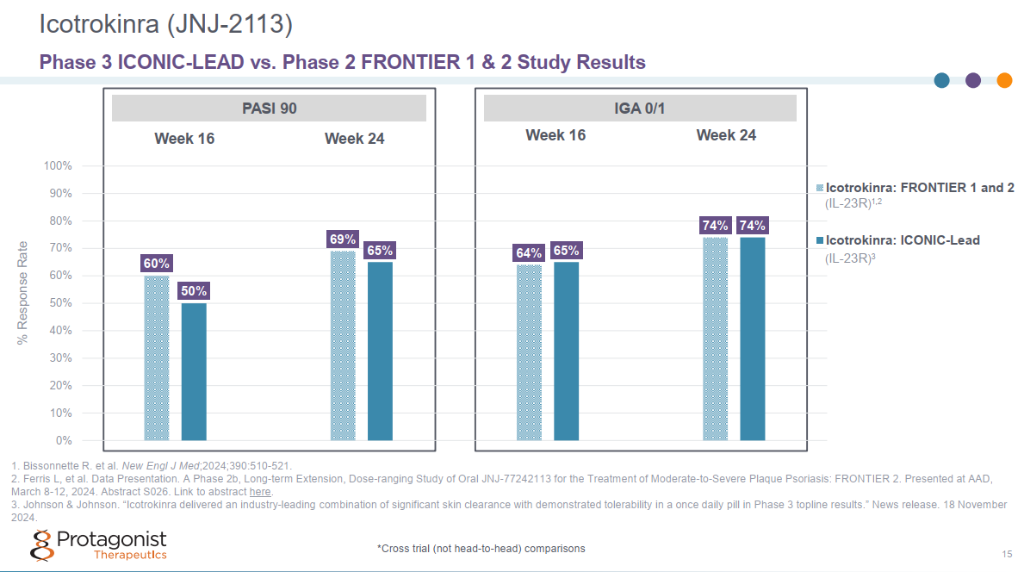
该 3 期临床研究在第 16 周达到了银屑病面积和严重程度指数 (PASI) 90和研究者总体评估 (IGA) 0/1的共同主要终点,并且响应率在第 24 周持续改善。
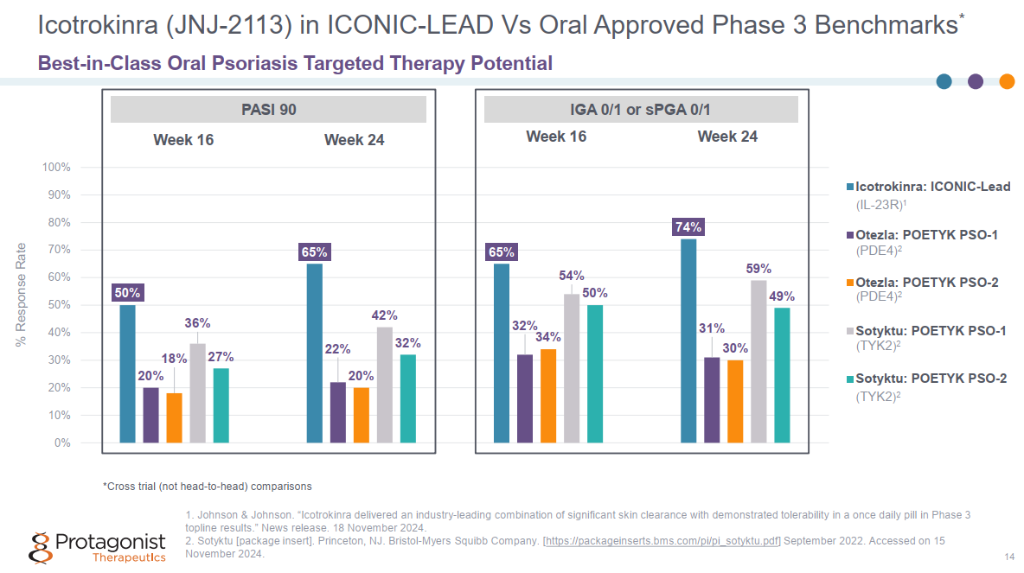
与安慰剂相比,每日一次的icotrokinra在患有中度至重度斑块状银屑病的成人和青少年中表现出显著的皮肤清除效果。在第16周,近三分之二 (64.7%) 接受icotrokinra治疗的患者 IGA 评分达到 0/1(皮肤清除或几乎清除),49.6% 达到 PASI 90,而接受安慰剂治疗的患者分别为 8.3% 和 4.4%。在第24周,响应率继续增加,74.1%接受icotrokinra治疗的患者 IGA评分达到0/1,64.9%达到PASI 90。
安全性数据与二期临床 FRONTIER 1 和 2 研究一致。
Icotrokinra和安慰剂组出现不良事件 (AE) 的患者比例相似,第 16 周时分别有 49.3% 和 49.1% 的受试者出现治疗中出现的不良事件 (TEAE) 。

此外,三期临床ICONIC-TOTAL研究的积极顶线结果显示,与安慰剂相比,每日一次的icotrokinra在第16周达到了IGA 0/1的主要终点。ICONIC-LEAD 和 ICONIC-TOTAL 的综合结果正在准备在即将召开的医学大会上展示,并将在计划提交的文件中与卫生当局分享。|
市场前景广阔。

强生创新医学副总裁、免疫皮肤病领域负责人 Liza O'Dowd 表示:“我们很高兴看到日用口服icotrokinra治疗取得了令人印象深刻的三期临床结果,这与我们对这种首创的选择性阻断 IL-23 受体的口服靶向肽的二期研究一致。” “大多数中度至重度斑块状银屑病患者有资格接受但尚未接受的先进疗法。icotrokinra有潜力提供每日一次的口服疗法,有助于满足斑块状银屑病患者的需求和偏好。”
ICONIC 3期临床开发计划中的其他研究正在进行中,包括ICONIC-ADVANCE 1和ICONIC-ADVANCE 2,这些研究将评估icotrokinra与安慰剂和deucravacitinib(TYK2 变构抑制剂)相比在治疗中度至重度斑块性银屑病的安全性和有效性。ICONIC-PsA三期计划将于2025年初启动,该计划将研究icotrokinra在银屑病关节炎中的作用。
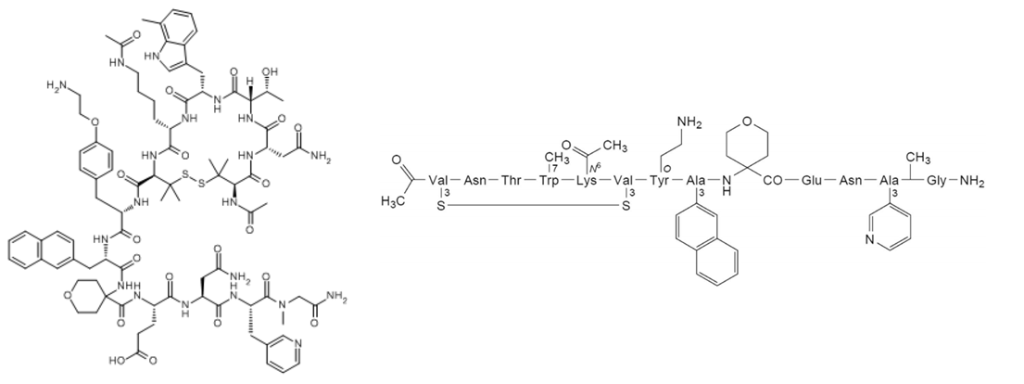
Icotrokinra(JNJ-2113)为一种大环肽,在人细胞中,可有效且选择性地抑制近端IL-23信号传导,而不影响IL-12的信号。结构如下(左为结构,右为序列):
临床前,相比于第一代PTG-200,具有更高的活性,具有跟IL-23抗体相似的亲和力。稳定性更好,不受肠道局限。

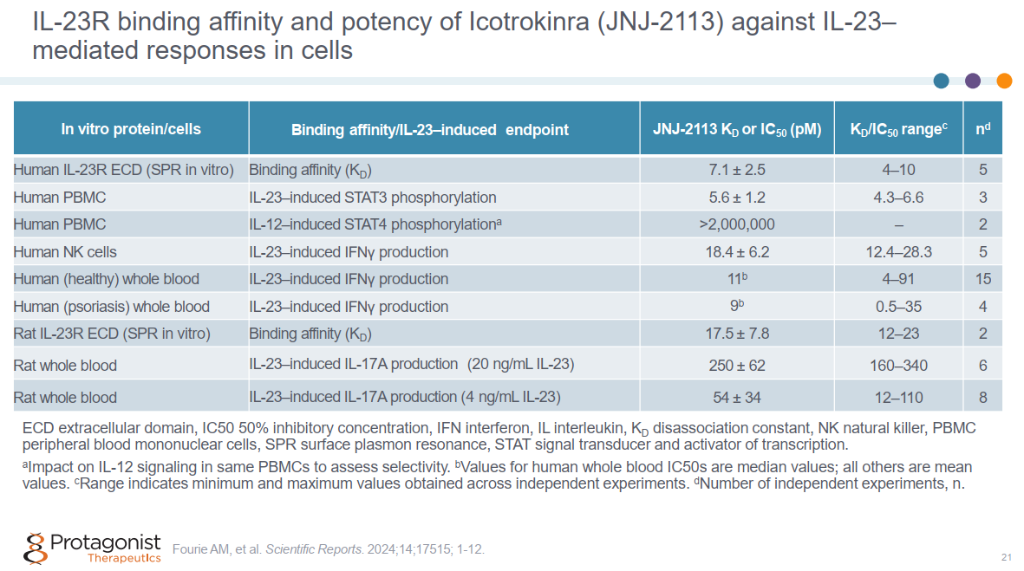
Icotrokinra (JNJ-2113)在IL-23介导的细胞实验中展现了较好的体外药效。
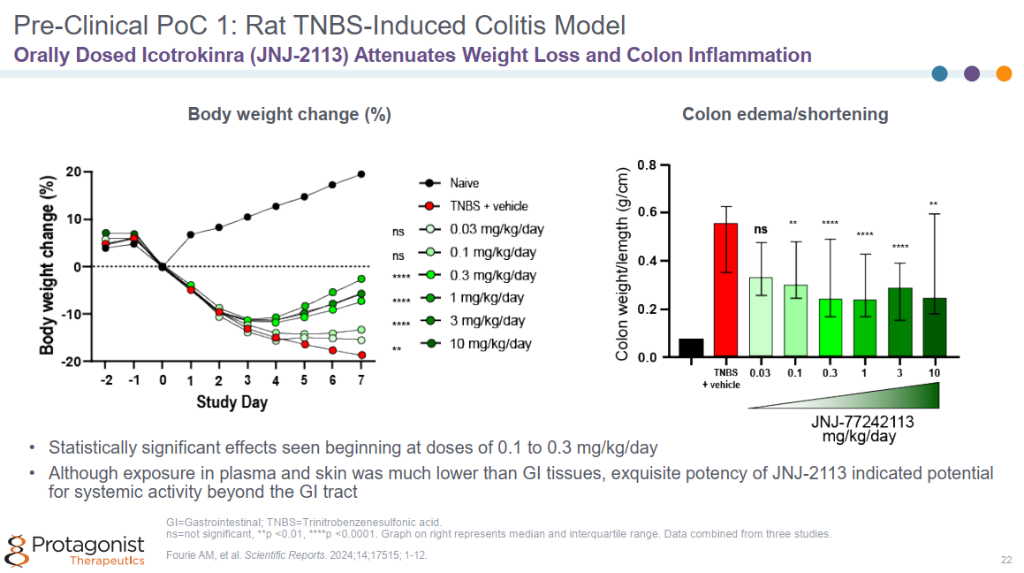
大鼠TNBS(三硝基苯磺酸)诱导结肠炎模型中,展现了良好的药效,减缓体重下降和结肠炎症。
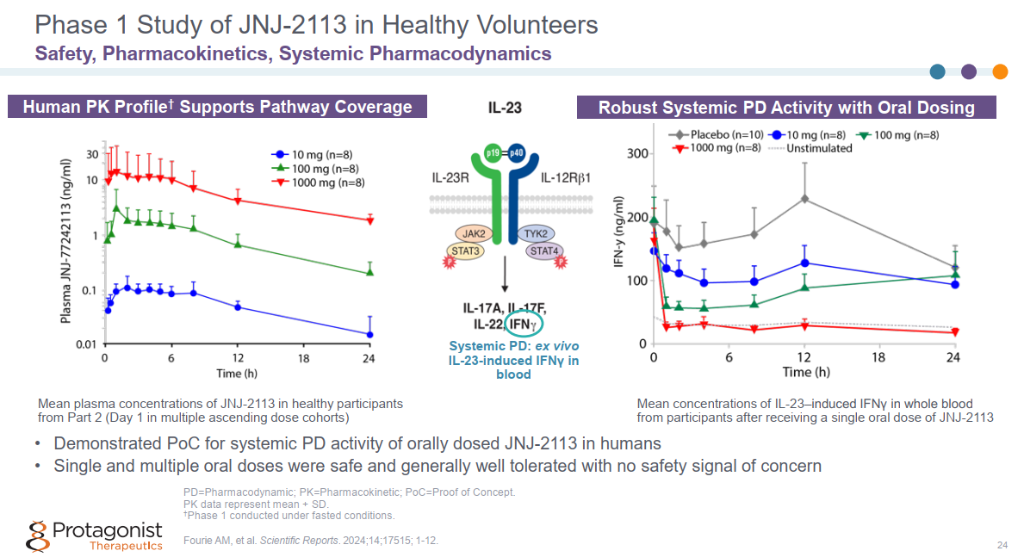
在大鼠IL-23诱导的皮肤炎症模型中,口服Icotrokinra (JNJ-2113)达到与抗IL-23抗体等效的抑制作用。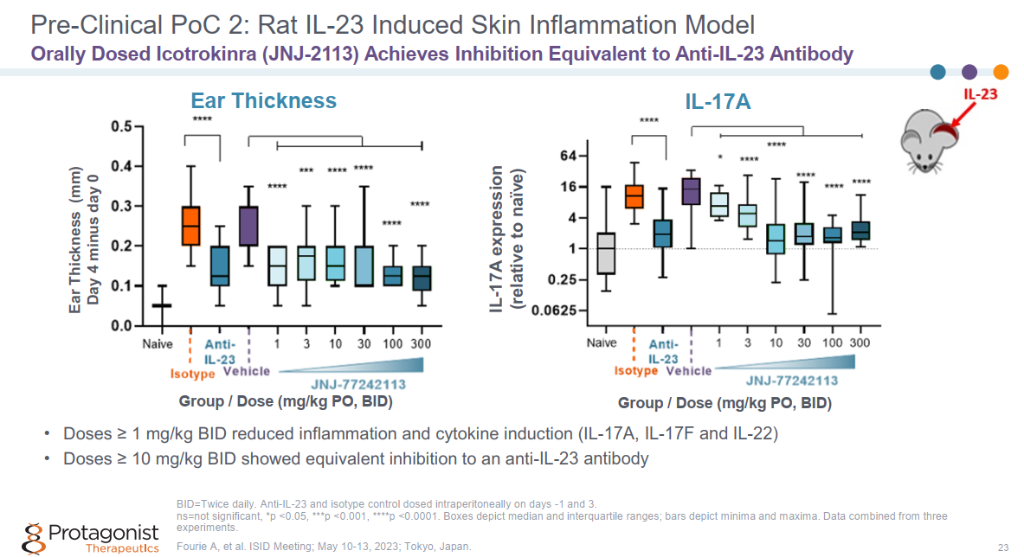 Icotrokinra (JNJ-2113)展现了良好的PK。
Icotrokinra (JNJ-2113)展现了良好的PK。
通过二期数据对比,Icotrokinra (JNJ-2113)具有最优的疗效数据,具有可比性的就是Tremfya (Guselkumab,古塞奇尤单抗是一种重组人源性 IgG1 单克隆抗体,针对 IL-23p19 亚基)和TYK2抑制剂TAK-279。
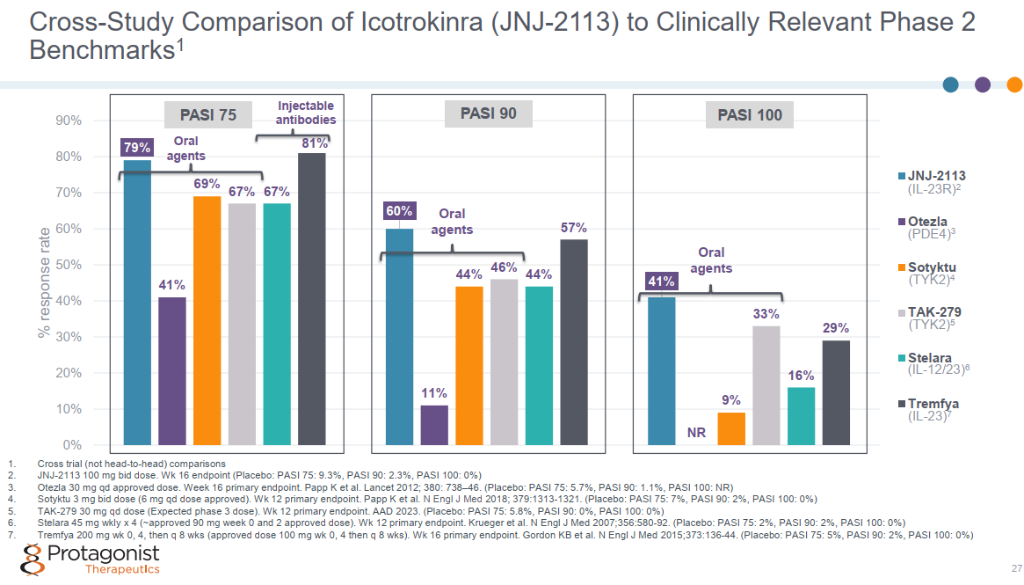
口服型多肽,相比于小分子具有更好的特异性及亲和力,同时相比于抗体,又具有口服的特性,可谓兼具两者的优点。同时,也可以尝试借鉴司美格鲁肽设计的理念,加上脂肪酸链来延长半衰期,降低患者费用。