近日(12月4日),Merus的HER2/HER3双抗Zenocutuzumab获得FDA加速批准其上市,用于治疗神经调节蛋白1融合非小细胞肺癌 (NSCLC) /胰腺导管腺癌 (PDAC) 患者,商品名为Bizengri。
Zenocutuzumab是全球首个获批的HER3靶向药,也是FDA批准的首个针对NRG1+PDAC和NSCLC的新疗法。
Zenocutuzumab是一种HER2/HER3双特异性抗体,可与表达在细胞表面(包括肿瘤细胞)的HER2和HER3的细胞外结构域结合,抑制HER2与HER3形成二聚体并阻止NRG1与HER3的结合。通过减少细胞增殖及PI3K-AKT-mTOR信号通路传导发挥作用。此外,Zenocutuzumab还能介导抗体依赖的细胞毒性(ADCC)作用。
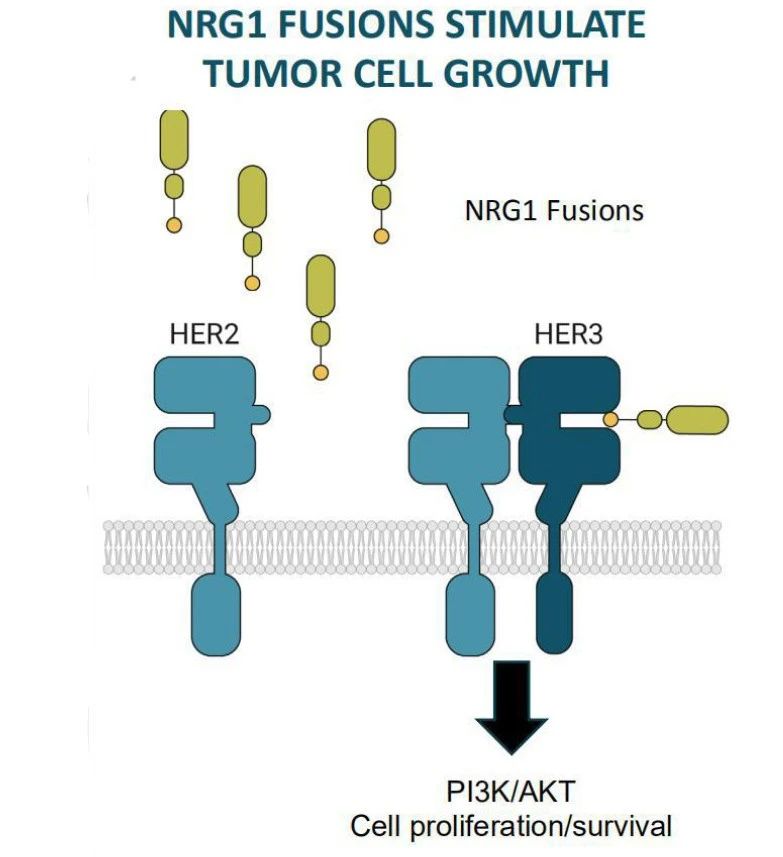
Zenocutuzumab的获批是基于一项多中心、开放标签的Ⅰ/Ⅱ期临床试验eNRGy,该项临床招募了晚期不可切除或转移性NRG1+PDAC/NRG1+NSCLC患者。
在NRG1+PDAC(n=30)患者中,Zenocutuzumab的总缓解率为40%,缓解持续时间为3.7个月至16.6个月。NRG1+NSCLC患者(n=64)的总缓解率为33%,中位缓解持续时间为7.4个月。
事实上,zenocutuzumab的上市申请此前因CMC问题遭到了FDA延期,在2024年11月5日,FDA将zenocutuzumab的PDUFA目标日期延长了3个月,至2025年2月4日,原来的PDUFA日期是2024年11月4日。
不过,Merus应该是很快就解决了CMC方面的顾虑,使得FDA仍然还是在原PDUFA日期前完成了审查。
HER3是HER家族成员,自1989年发现以来已超过30年。研究发现,HER3在多个癌种中呈现高表达,并且与肿瘤转移和疾病进展密切相关,是一个潜力肿瘤靶点。
不过,由于其细胞内酪氨酸激酶活性极弱,HER3的成药性一直是个难题,靶向HER3单抗的开发基本上都以失败告终,这也为HER3靶向药的开发蒙上了一层阴影,但是随着ADC、双抗等新技术成熟,HER3的成药性已大大提高。
事实上,如果审批顺利,抢先拿下首个HER3靶向药的应该是第一三共/默沙东的HER3-DXd。
在2023年12月22日,FDA基于II期临床试验数据(HERTHENA-Lung01),受理了HER3-DXd的上市申请,并授予了优先审评,PDUFA日期定于2024年6月26日。
不过因为第三方生产设施问题,FDA在这一天向第一三共/默沙东发出了完整回复函(CRL),暂时拒绝批准上市。
此外,在2024年6月17日,BioNTech/宜联生物HER3 ADC(YL202/BNT326)的部分I期临床试验遭到了FDA搁置,原因是担忧该药物在较高剂量下可能给受试者带来显著的风险。在2024年8月19日,YL202又获得了FDA的解除。
参考出处
https://www.globenewswire.com/news-release/2024/12/04/2991955/37568/en/Merus-Announces-FDA-Approval-of-BIZENGRI-zenocutuzumab-zbco-for-NRG1-Pancreatic-Adenocarcinoma-and-NRG1-Non-Small-Cell-Lung-Cancer-NSCLC-Based-on-Safety-and-Efficacy-Data-From-the-.html