近日,复宏汉霖宣布斯鲁利单抗联合化疗一线治疗广泛期小细胞肺癌(ES-SCLC)的随机、双盲、国际多中心III期临床研究的第一次期中分析达到了总生存期(OS)的主要研究终点。
当前,全球仅有两款PD-L1单抗获批一线治疗SCLC,斯鲁利单抗成为首个在SCLC一线适应症上取得III期阳性结果的PD-1单抗。
消息一出,有人欣喜,也有人保持谨慎态度。
毕竟,前车之鉴历历在目,帕博利珠单抗联合化疗一线治疗ES-SCLC的III期KEYNOTE-604研究中,OS并没有达到预期的统计学差异,最后以K药主动撤回适应症告终。
同样是PD-1单抗,如何理解两种截然不同的故事走向?
在此,我们对小细胞肺癌免疫治疗的成与败,以及国内各大药企正在开展的临床研究作一盘点分析,供大家参考。
明知山有虎,偏向虎山行
小细胞肺癌历来以复杂难懂的肿瘤发生发展机制、短暂的生存期和微乎其微的治疗进展著称。
IMpower133 研究是四十年来首个系统治疗研究中获得OS改善的III期研究,与标准化疗相比,阿替利珠单抗联合化疗为ES-SCLC带来2个月的OS改善,降低 30%死亡风险,成为SCLC治疗史上的里程碑研究。
随后,CASPIAN研究同样证实度伐利尤单抗联合卡铂或顺铂/依托泊苷可以为 ES-SCLC 带来相似的生存获益,延长2.7个月生存,降低27%死亡风险,进一步验证了 IMpower133 研究的结果。
基于IMpower133和CASPIAN 研究,FDA分别于2019年3月和2020年3月批准了阿替利珠单抗和度伐利尤单抗联合标准化疗一线治疗ES-SCLC的适应症,并获得国内外指南的一致推荐。
然而,另外两种PD-1抗体——纳武利尤单抗和帕博利珠单抗(最初在晚期SCLC背景下获得FDA批准),却因为确证性试验的阴性OS结果,而陆续撤销适应症。
今年10月,恒瑞的PD-L1单抗SHR-1316(阿得贝利单抗)联合化疗一线治疗广泛期ES-SCLC的III期研究达到了OS的主要研究终点,打响了在小细胞肺癌这一适应症上国产替代的“发令枪”。
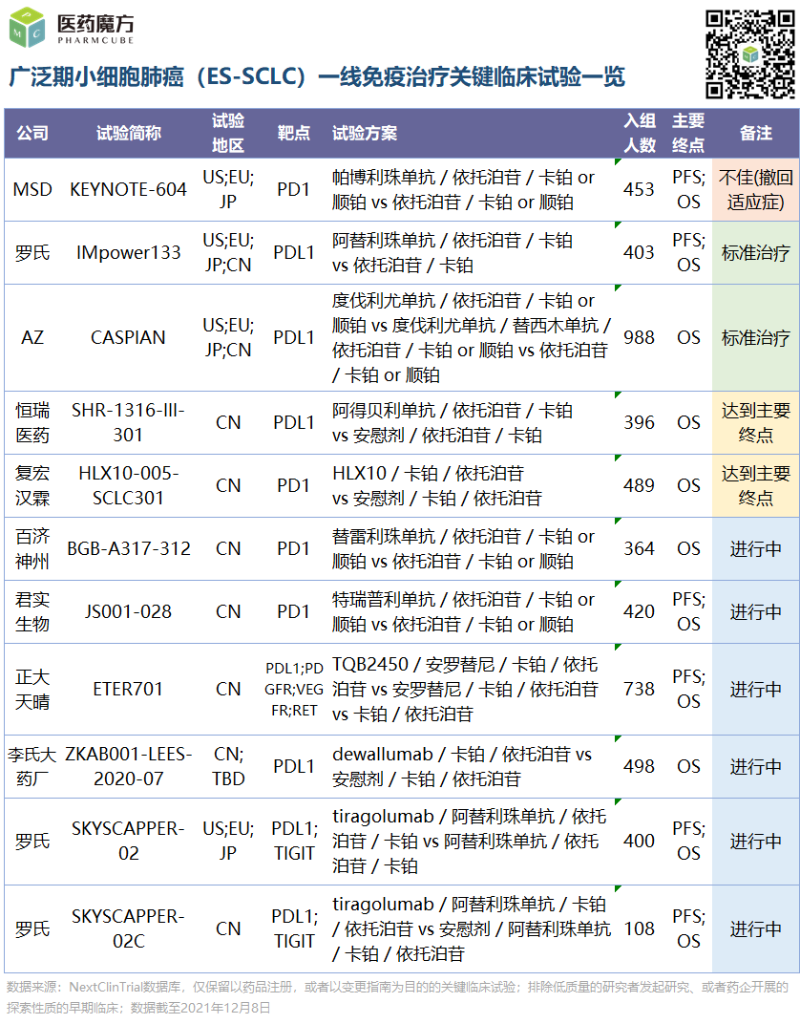
回过头来简单看一下国内PD-(L)1的现状,会发现基本也是fast-follow了国际巨头的步伐。不同之处在于,恒瑞、正大天晴、李氏大药厂押宝PD-L1,复宏汉霖、百济神州、君实生物则是下注PD-1。其中一个比较新颖的方案是正大天晴TQB2450+安罗替尼+化疗的方案引入了抗血管生成治疗,此外罗氏也分别在中国和全球开展TIGHT抑制剂与PD-L1单抗的联合探索。
当下,斯鲁利单抗III期阳性结果的公布,无疑为PD-1在SCLC的应用前景注入了一丝信心。
没有绝对的成败,而是多维的博弈
根据复宏汉霖的新闻稿可知,斯鲁利单抗针对ES-SCLC的III期研究在亚洲、欧洲多个国家同步开展,全球共入组580多例受试者,这也是首个由中国研究者牵头开展的针对ES-SCLC适应症的最大规模PD-1单抗国际多中心临床研究。(编者注:查阅Clinicaltrials官网尚未登记国外中心的具体入组情况)
目前得到的阳性OS结果,是否可以“摆脱”此前PD-1一线失利的阴影,获得国内乃至国外监管机构认可,为患者提供一种全新的治疗选择?
详细数据披露之前,答案无从得知。
坐等吃瓜之时,不妨反过来思考,KEYNOTE-604的阴性OS结果,是否百分百意味着PD-1联合方案的探索毫无意义?或者更进一步,O药、K药撤回适应症,难道就代表着PD-1在SCLC的全军覆没吗?
失败乃成功之母。如果不是O药和K药最早通过加速批准途径在晚期难治性SCLC的获批,成功开启了免疫疗法在SCLC的探索之路,或许后续的试验也不会有信心将免疫疗法联合化疗前移至一线治疗,几十年来首次带来生存获益。
尽管验证性试验失败,导致O药和K药自愿撤回SCLC适应症,但SCLC患者最终从免疫治疗开发中获益,也是不争的事实。
更何况,未能达到其终点的临床试验并不一定表明药物无效。借由FDA肿瘤卓越中心(OCE)近日发表在JAMA oncol的一篇评论文章《Immunotherapy for Patients With Small-Cell Lung Cancer-2 Gains, 2 Losses》中所提到的,“主要研究终点、把握度(power)计算、分层检验步骤(hierarchical testing procedures)和患者人群的差异,都可能导致验证性试验的失败。”
成功的样子千篇一律,失败的总结万里挑一
刚刚说到的是,从宏观层面辨证看待PD-1和PD-L1在小细胞肺癌的探索,没有绝对的成败,而是多维的博弈。但辩证归辩证,接受来自监管机构、临床专家等专业人士的拷问和质疑,本来就是每一项临床研究的命运。
虽然单凭一项III期研究无法给PD-1一线治疗ES-SCLC的“盖棺定论”,但K药和斯鲁利单抗同属PD-1,为何“阴阳两隔”?后者有何骨骼清奇之处?到底是药物疗效不同、试验设计差异、患者人群选择、还是统计分析原因....
根据目前“极其有限”的信息披露,两项临床试验设计的最大区别或许在于KEYNOTE-604是PFS和OS双终点,而斯鲁利单抗是OS单终点。笔者还有一点个人揣测,KEYNOTE-604启动是在2017年,彼时对于免疫治疗的延迟效应尚未深入认识;斯鲁利单抗是2019年启动,对于PD-1预期疗效更全面的认知或可帮助其在临床试验设计上规避不必要的风险。
广泛期SCLC一线IO治疗研究最新数据
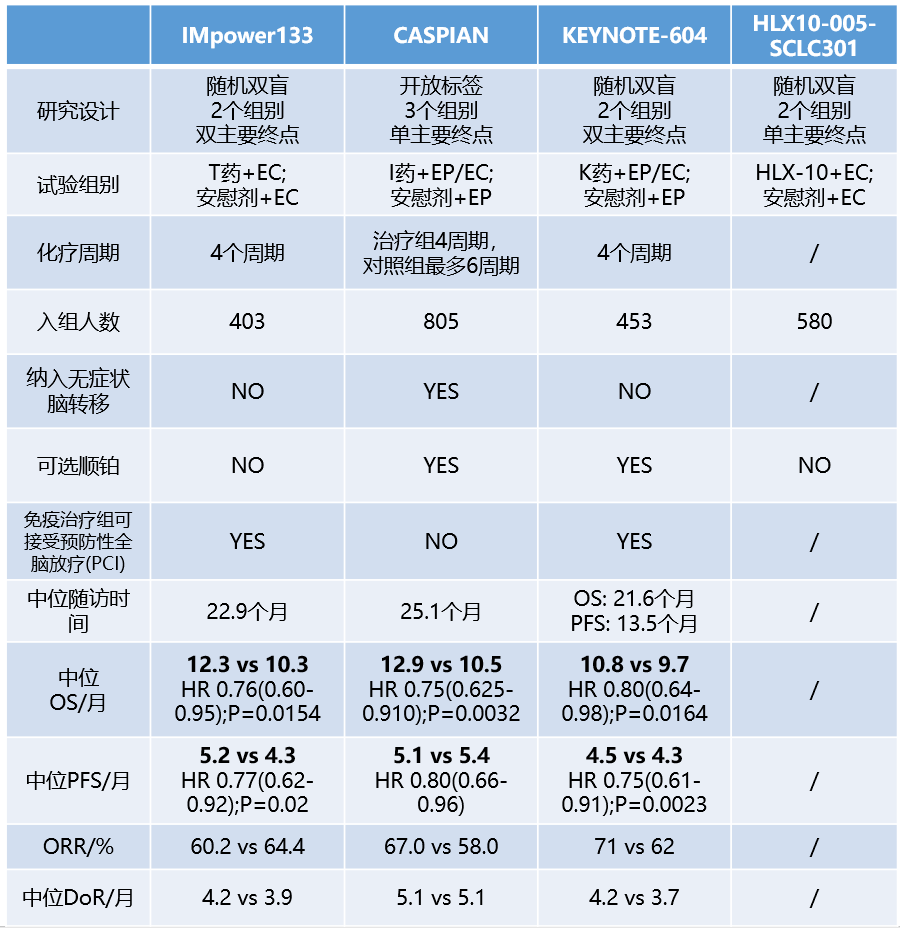
数据来源:IMpower133 :2019 ESMO Abstract 2374. CASPAIN:Lancet Oncol. 2020 Dec4;S1470-2045(20)30539-8. KEYNOTE-604:J Clin Oncol. 2020 Jul 20;38(21):2369-2379.HLX10-005-SCLC301: clinicaltrial.gov.
针对成功的审视,尚且需要耐心等待更多数据的公布;不妨先来唠一唠大家眼中失败的KEYNOTE-604研究。
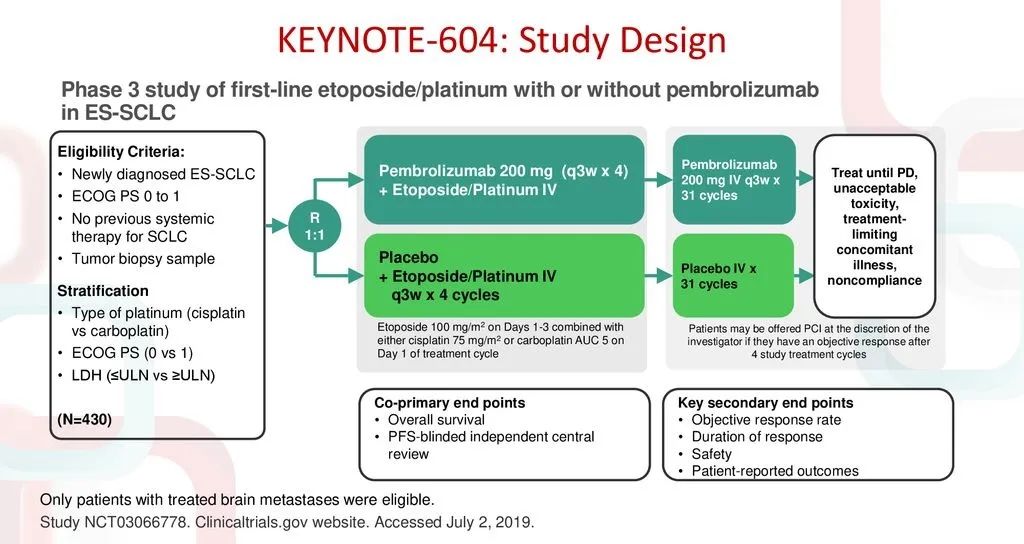
这是一项随机、双盲、Ⅲ期临床研究,符合条件的453例ES-SCLC患者,按照1:1随机分配接受帕博利珠单抗 200mg或安慰剂治疗35个周期或至疾病进展,每3周一次,初始4周期加EP方案。
主要终点为PFS和OS。预先设定的OS检验界限是单侧P=0.0128,最终分析时P=0.0164。虽然生存曲线最终呈现明显分开的趋势,0.0036的微弱差距却遗憾造就阴性OS结果。
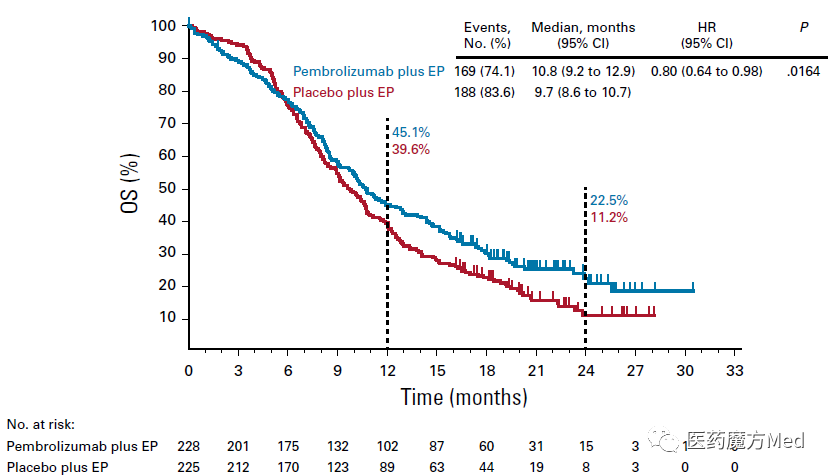
KEYNOTE-604研究的OS曲线(来源:JCO)
一方面,从临床疗效的角度,虽然无论是PFS还是OS,两条线都分得很开,但换算成实际获益就不一定了。拿PFS来说,虽然风险比为0.75,P值低至0.0023,帕博利珠单抗/安慰剂+EP组的中位PFS相差仅0.2个月,也就是短短6天时间。考虑到经济负担和不良反应,绝大多数临床医生都不会接受35个周期的PD-1联合治疗,最后只有6天的受益。
此外,PFS的绝对值差异(4.5个月 vs. 4.3个月)小于OS(10.8个月 vs. 9.7个月),考虑到OS受到后续治疗的影响,这在临床试验中并不常见,也是一个有很有意思的问题。
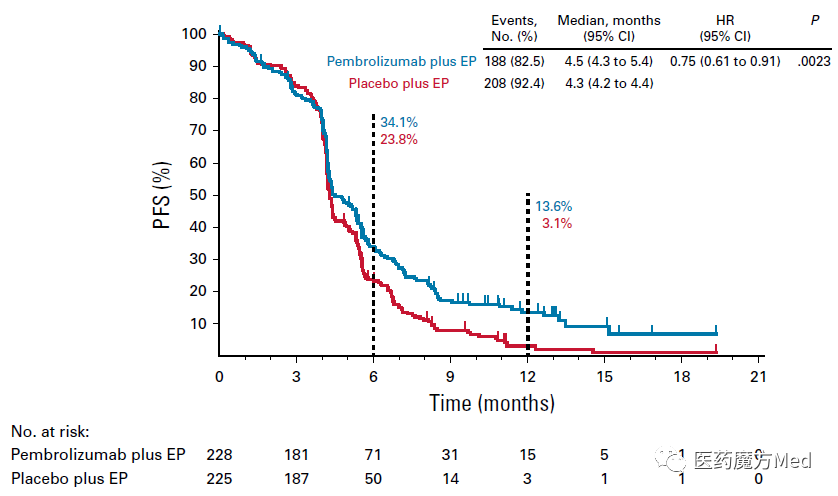
KEYNOTE-604研究的PFS曲线(来源:JCO)
另一方面,从统计分析的角度,初始设计对effect size(HR)的高估,导致研究效能(power)不足和样本量被低估,第二次期中分析过多消耗αlpha值,最终达到统计学差异的难度增加,从而得到阴性结果;这也意味着,假如采取更“高明”的αlpha分配,甚至不做期中分析,也不排除获得阳性OS结果的可能。
(注:以有效性为目的的期中分析是将整体决策按照时间顺序分阶段进行的典型代表,每个阶段都进行一次整体决策,确定试验因有效或无效提前终止还是继续。多阶段决策需要多重性调整,即每个阶段都会消耗一定的α值。)
这里稍微延伸一点。现在很多研究都会进行期中分析,以便根据实际情况提前中止研究、扩大样本量、改变入组策略、乃至停止试验。然而期中分析好像又是一个潘多拉魔盒,消耗αlpha势必导致后续统计学差异的难度增加。
有生物统计师介绍:“一项III期研究设计需要考虑的因素很多:有没有其他药厂开展类似研究?竞争对手的时间进度如何?药监部门的意见?......近年来新型靶向免疫治疗发展迅猛,竞争也非常激烈,大家其实都是在摸着石头一点点过河,但又要抢占先机,大部分时候等不及II期结果出来就启动了III期研究。换句话说,一些情况下期中分析的次数和时间点也受竞争环境的很大影响。”
或许还有人会问,SCLC易复发、预后差,是一类非常容易看到生存结果的瘤种,为何不设计OS单终点,而要设计PFS和OS双终点,增加成功的难度?
毕竟,OS是评估抗肿瘤药物疗效的金标准,PFS虽是常见的替代终点,但不一定能转化为OS获益,因为疾病进展后续治疗可能会减少最初的获益程度。在部分生存期较长的瘤种,凭借PFS加速获批的案例比比皆是,尚且面对不少争议;对于SCLC而言,设计PFS和OS双终点的考量何在?篇幅所限,本文暂不展开介绍,希望日后有机会再来唠一唠双终点设计的利与弊。
写在最后
前瞻性研究充满着挑战,充满着机遇,也同样存在有很多风险。在一定程度上,很多东西无法提前预测,很多经验也就是从这些失败的案例中积累,然后不断的改良统计设计/分析的方法,并不断的去适应、去应对各种各样未遇到的状况,从而尽可能提高试验成功的概率。
药物临床试验的信息量犹如冰川,大部分人所了解的只有冰山一角。这也提示我们,对于临床研究的解读绝不能仅限于某一个点,而在于信息披露的全面、公开、透明,临床意义和统计学意义的综合分析。
注:原文有删减
*声明:本文由入驻新浪医药新闻作者撰写,观点仅代表作者本人,不代表新浪医药新闻立场。